
Karbodiimid (systematiskt IUPAC-namn: metandiimin[1]) är en funktionell grupp med den allmänna formeln R-N=C=N-R'. De är fuktkänsliga och hydrolyseras lätt till karbamider. På jorden är de uteslutande syntetiska, men i den interstellära rymden har moderföreningen HN=C=NH upptäckts genom dess maseremission.[2] De används flitigt som kopplingsreagens vid amidkopplingar.
En välkänd karbodiimid är dicyklohexylkarbodiimid, som används i peptidsyntes.[3] Dialkylkarbodiimider är stabila. Vissa diarylderivat tenderar att omvandlas till dimerer och polymerer när de förvaras i rumstemperatur, även om detta oftast sker med lågsmältande karbodiimider som är vätskor vid rumstemperatur.[4]Fasta diarylkarbodiimider är mer stabila, men kan över tiden långsamt genomgå hydrolys i närvaro av vatten.
Struktur och bindning

Ur bindningsperspektiv är karbodiimider isoelektroniska med koldioxid. Tre huvudsakliga resonansstrukturer beskriver karbodiimider:
- RN=C=NR ↔ RN+≡C-N−R ↔ RN−-C≡N+R
N=C=N-kärnan är relativt linjär och C-N=C-vinklarna närmar sig 120°. I fallet med C(NCHPh2)2 är den centrala N=C=N-vinkeln 170° och C-N=C-vinklarna är inom 1° från 126°.[5] C=N-avstånden är korta, nästan 120 pm, vilket är karakteristiskt för dubbelbindningar. Karbodiimider är kirala, har C2-symmetri och därför axiell kiralitet.[6] På grund av lågenergibarriären för att molekylen roterar och därigenom snabbt omvandlas mellan dess isomerer, är den faktiska isoleringen av en optisk isomer av en karbodiimid extremt svår. Det har visats minst en gång, i fallet med konformationsmässigt begränsade cykliska karbodiimider och även om det finns andra rapporter om enhandsaxiellt kirala karbodiimider, har deras giltighet senare ifrågasatts genom experiment och beräkningar.[7][8]
Moderföreningen, metandiimin, (HN=C=NH), är en tautomer av cyanamid.
Synteser
Från tiokarbamider och karbamider
En klassisk väg till karbodiimider är dehydrosulfurisering av tiokarbamider. Ett typiskt reagens för denna process är kvicksilveroxid:[9]
- (R(H)N)2CS + HgO → (RN)2C + HgS + H2O
Denna reaktion kan ofta utföras som avsett, även om karbodiimider reagerar med vatten. I vissa fall tillsätts ett dehydratiseringsmedel till reaktionsblandningen.
Dehydreringen av N,N'-dialkylkarbamider ger karbodiimider:
- (R(H)N)2CO → (RN)2C + H2O
Fosforpentoxid[10] och p-toluensulfonylklorid har använts som dehydratiseringsmedel.[11][12]
Från isocyanater
Isocyanater kan omvandlas till karbodiimider med avgång av koldioxid:[13][4]
- 2 RN=C=O → (RN)2C + CO2
Reaktionen katalyseras av fosfinoxider och är reversibel.[9]
Reaktioner
Jämfört med andra heteroallener är karbodiimider mycket svaga elektrofiler och reagerar endast med nukleofiler i närvaro av katalysatorer, såsom syror.[14] På detta sätt kan guanidiner framställas.[3] Som svaga baser binder karbodiimider till Lewis-syror för att ge addukter.[9]
Moffatt-oxidation
Karbodiimider är reagenser för Moffatt-oxidation, ett protokoll för omvandling av en alkohol till en karbonyl (keton eller aldehyd) med dimetylsulfoxid som oxidationsmedel:[15]
- (CH3)2SO + (CyN)2C + R2CHOH → (CH3)2S + (CyNH)2CO + R2C=O
Vanligtvis används sulfoxid och diimid i överskott.[16]Reaktionen genererar dimetylsulfid och en urea som biprodukter.
Kopplingsmedel
I organisk syntes används föreningar som innehåller karbodiimidfunktionaliteten som dehydreringsmedel. Specifikt används de ofta för att omvandla karboxylsyror till amider eller estrar. Tillsatser, såsom N-hydroxibensotriazol eller N-hydroxisuccinimid, tillsätts ofta för att öka utbytet och minska sidoreaktioner.
Polykarbodiimider kan också användas som tvärförbindningar för vattenhaltiga hartser, såsom polyuretandispersioner eller akryldispersion. Här reagerar polykarbodiimiden med karboxylsyror, vars funktionella grupper ofta finns i sådana vattenhaltiga hartser, för att bilda N-acylurea. Resultatet är bildandet av kovalenta bindningar mellan polymerkedjorna, vilket gör dem tvärbundna.[17][18]
Amidbildningsväg
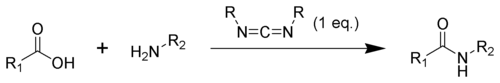
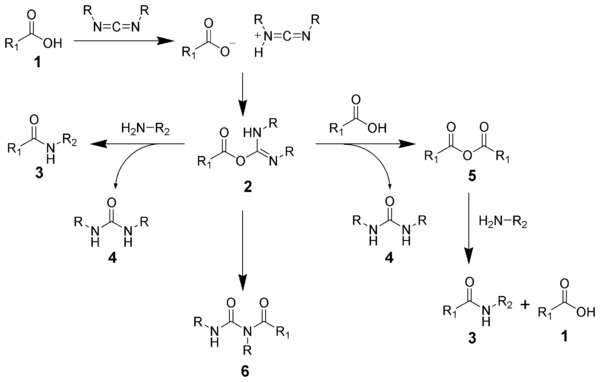
Bildandet av en amid med en karbodiimid är en vanlig reaktion, men medför risk för flera sidoreaktioner. Syran 1 kommer att reagera med karbodiimiden för att producera nyckelmellanprodukten O-acylisourea 2, som kan ses som en karboxylsyraester med en aktiverad lämnande grupp. O-acylisourea kommer att reagera med aminer för att ge önskad amid 3 och urea 4.
De möjliga reaktionerna av O-acylisourea 2 ger både önskade och oönskade produkter. O-acylisourea 2 kan reagera med ytterligare en karboxylsyra 1 för att ge en syraanhydrid 5, som kan reagera ytterligare för att ge amiden 3. Den huvudsakliga oönskade reaktionsvägen orsakas av omarrangemang av O-acylisourea 2 till den stabila N-acylurean 6. Användningen av lösningsmedel med låga dielektriska konstanter som diklormetan eller kloroform kan minimera denna bireaktion.[19]
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Carbodiimide, 20 augusti 2023.
Noter
- ^ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. sid. 375. doi:. ISBN 978-0-85404-182-4. ”The name carbodiimide, for HN=C=NH, is retained but only for general nomenclature; no substitution of any kind is allowed. The systematic name, methanediimine, is the preferred IUPAC name.”
- ^ McGuire, Brett A.; Loomis, Ryan A.; Charness, Cameron M.; Corby, Joanna F.; Blake, Geoffrey A.; Hollis, Jan M.; Lovas, Frank J.; Jewell, Philip R.; et al. (2012-10-20). ”Interstellar Carbodiimide (HNCNH): A New Astronomical Detection from the GBT Primos Survey Via Maser Emission Features”. The Astrophysical Journal 758 (2): sid. L33. doi:. ISSN 2041-8205. Bibcode: 2012ApJ...758L..33M. https://iopscience.iop.org/article/10.1088/2041-8205/758/2/L33.
- ^ [a b] Andrew Williams; Ibrahim T. Ibrahim (1981). ”Carbodiimide Chemistry: recent Advances”. Chem. Rev. 81 (6): sid. 589–636. doi:.
- ^ [a b] T. W. Campbell; J. J. Monagle (1963). ”Diphenylcarbodiimide”. Org. Synth. 43: sid. 31. doi:.
- ^ [a b] Irngartinger, H.; Jäger, H.-U. (1978). ”Kristall- und Molekularstrukturen von zwei Carbodiimiden: Bis(diphenylmethyl)carbodiimid und Bis(p-methoxyphenyl)-carbodiimid”. Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry 34 (11): sid. 3262–3265. doi:.
- ^ Vincent, A. T.; Wheatley, P. J. (1972). ”Crystal Structure of Bis-p-nitrophenylcarbodiimide, O2N·C6H4·N:C:N·C6H4·NO2”. Journal of the Chemical Society, Perkin Transactions 2 (11): sid. 1567–1571. doi:.
- ^ Taniguchi, Tohru; Suzuki, Takahiro; Satoh, Haruka; Shichibu, Yukatsu; Konishi, Katsuaki; Monde, Kenji (2018). ”Preparation of Carbodiimides with One-Handed Axial Chirality”. Journal of the American Chemical Society 140 (46): sid. 15577−15581. doi:. PMID 30398863. https://pubs.acs.org/doi/pdf/10.1021/jacs.8b08969. Läst 18 augusti 2020.
- ^ Damrauer, Robert; Lin, Hai; Damrauer, Niels H. (2014). ”Computational Studies of Carbodiimide Rings”. Journal of Organic Chemistry 79 (9): sid. 3781−3788. doi:. PMID 24716711. https://pubs.acs.org/doi/pdf/10.1021/jo4026435. Läst 18 augusti 2020.
- ^ [a b c] Frederick Kurzer; K. Douraghi-Zadeh (1967). ”Advances in the Chemistry of Carbodiimides”. Chem. Rev. 67 (2): sid. ee107–152. doi:. PMID 4859920.
- ^ Henri Ulrich (2008). Chemistry and Technology of Carbodiimides. Wiley-VCH. ISBN 978-0-470-06510-5
- ^ John C. Sheehan; Philip A. Cruickshank (1968). ”1-Ethyl-3-(3-Dimethylamino)propylcarbodiimide Hydrochloride and Methiodide”. Org. Synth. 48: sid. 83. doi:.
- ^ Arnab K. Maity; Skye Fortier; Leonel Griego; Alejandro J. Metta-Magaña (2014). ”Synthesis of a "Super Bulky" Guanidinate Possessing an Expandable Coordination Pocket”. Inorg. Chem. 53 (15): sid. 8155–8164. doi:. PMID 25029088.
- ^ Monagle, J. J. (1962). ”Carbodiimides. III. Conversion of Isocyanates to Carbodiimides. Catalyst Studies”. J. Org. Chem. 27 (11): sid. 3851–3855. doi:.
- ^ Li, Zhen; Mayer, Robert J.; Ofial, Armin R.; Mayr, Herbert (2020-04-27). ”From Carbodiimides to Carbon Dioxide: Quantification of the Electrophilic Reactivities of Heteroallenes”. Journal of the American Chemical Society 142 (18): sid. 8383–8402. doi:. PMID 32338511.
- ^ Tidwell, T. T. (1990). ”Oxidation of Alcohols by Activated Dimethyl Sulfoxide and Related Reactions: An Update”. Synthesis 1990 (10): sid. 857–870. doi:.
- ^ John G. Moffatt (1967). ”Cholane-24-al”. Org. Synth. 47: sid. 25. doi:.
- ^ Hesselmans, L. C. J.; Derksen, A. J.; van den Goorbergh, J. A. M. (2006). ”Polycarbodiimide crosslinkers”. Progress in Organic Coatings 55 (2): sid. 142–148. doi:. ISSN 0300-9440.
- ^ Posthumus, W.; Derksen, A. J.; van den Goorbergh, J. A. M.; Hesselmans, L. C. J. (2007). ”Crosslinking by polycarbodiimides”. Progress in Organic Coatings 58 (2–3): sid. 231–236. doi:. ISSN 0300-9440.
- ^ Hotan Mojarradi (2010). Coupling of substances containing a primary amine to hyaluronan via carbodiimide-mediated amidation (Thesis). Uppsala Universitet. ISSN 1650-8297.
Externa länkar
 Wikimedia Commons har media som rör Karbodiimid.
Wikimedia Commons har media som rör Karbodiimid.








